里程碑!ARX788拟纳入突破性治疗品种
5月18日,中国国家药监局药品审评中心(CDE)最新公示,由浙江新码生物医药有限公司(以下简称“新码生物”)和其母公司浙江医药股份有限公司联合申报的注射用重组人源化抗HER2单抗-AS269偶联物(ARX788)拟纳入突破性治疗品种,拟定适应症为:HER2阳性晚期乳腺癌二线治疗。
值得一提的是,ARX788已在2021年1月获得FDA授予快速通道资格,用于治疗已接受过一种或多种抗HER2治疗的晚期或转移性HER2阳性乳腺癌;并于2021年3月获得FDA授予孤儿药资格,用于治疗HER2阳性胃癌和胃食道结合部癌。

根据2021年世界卫生组织国际癌症研究机构(IARC)的数据,乳腺癌已经取代肺癌,成为全球第一大癌。乳腺癌目前是我国女性最高发的恶性肿瘤,2020年中国新发乳腺癌病例约42万,死亡约12万。新发乳腺癌中约3%~10%在确诊时即有远处转移,而早期患者中,30%~40%可发展为晚期,5年生存率仅20%,中位生存期为2~3年。约30%的原发性乳腺癌中存在HER2基因扩增,研究显示,HER2高表达与乳腺癌的无病生存期和总生存期的缩短相关,国内尚无抗HER2-ADC类药物在HER2阳性晚期乳腺癌二线治疗获批上市,存在巨大尚未被满足的临床需求。
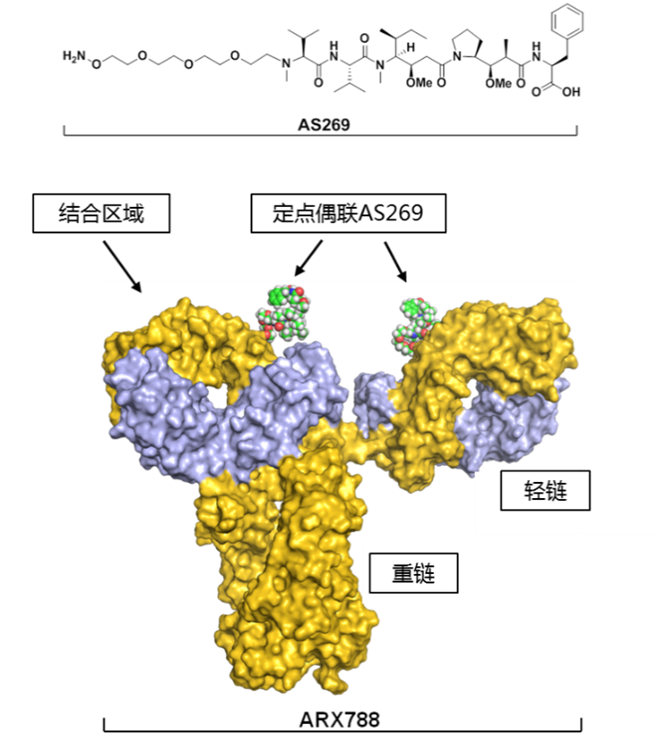
ARX788是抗体药物偶联物(ADC),由抗HER2单克隆抗体和毒素小分子AS269两部分组成。ARX788与细胞表面HER2结合,通过内吞进入细胞,在溶酶体中被水解,释放出pAF-AS269(修饰氨基酸连接毒性分子,为微管抑制剂),pAF-AS269结合微管蛋白,抑制细胞有丝分裂,诱导细胞周期停滞、死亡。ARX788利用非天然氨基酸专利定点偶联技术精确偶联有效负载,产生的ADC稳定性显著提高,药物与抗体的比例约为2。非临床数据显示,单次给药ARX788在HER2高、中等及低水平表达水平的细胞系中均表现出良好的活性;在多个体内异种移植模型中,也表现出优异的抗癌活性。因为ARX788的稳定性和均质性,比传统ADC有更好的PK表现,且更低的血液毒性,安全性更高。
ARX788的Ⅰ期临床研究在复旦大学附属肿瘤医院进行,胡夕春教授为PI,截止至2021.01.12,ARX788在HER2阳性晚期乳腺癌的临床数据表现出显著临床意义:1)疗效显著,总ORR为47.8%(33/69),其中1.5 mg/kg Q3W(II期推荐剂量)剂量组ORR为65.5%(19/29);仍有41.4%受试者[12/29]在组;2)绝大多数不良反应为轻度到中度,与药物相关的3级以上不良反应发生率为11.6%,具有显著的安全性优势。

2020年SABCS大会上更新的ARX788部分临床研究数据
新码生物董事长兼总经理梁学军表示:“ARX788是全球基于非天然氨基酸技术设计的首款ADC药物,国内的开发进度快于欧美。CDE拟纳入突破性治疗品种是对ARX788的高度肯定,我们将加倍努力争取让国人更早用上好药。”



