休眠癌细胞: 野火烧不尽, 春风吹又生
来自“无癌”状态捐献者的器官,在移植后给接受者带来肿瘤的病例,也偶有发生。
去年,American Journal of Transplantation 杂志报道了一个恶性肿瘤转移扩散的罕见病例[1],随后又被多家新闻媒体转载报道过(图1来自网络)。
图1. 各家报道(图片来自网络)
在这个不幸的例子里,一位死于脑出血的53岁女性捐献了自己的器官,移植给五名病人。除了接受心脏移植的病人术后不久即死于败血症,另四名接受了肝、肺和肾脏移植的病人均在术后顺利地活了下来。
然而,令人意外的是,这四名病人都不幸地在器官移植之后的16个月至6年期间,分别被诊断出了恶性肿瘤。而且,基因测序的结果显示,这四个人的肿瘤都是来自于器官捐献者的乳腺癌转移。
据分析,尽管那名器官捐献者在生前并不知道自己患有乳腺癌,且经过体检、实验室检测、X光以及超声波等一系列检查都没有发现问题,她实际上已经患有很早期的乳腺癌,而且就在这个连原位病灶都还无法被察觉和检测到的肿瘤很早期的阶段,她的乳腺癌细胞就已经随血液扩散到了本人的肝、肺、肾等器官中,之后又随着器官被移植到了别人的身体里。
一般情况下,癌症是不传染的,即使一个人的癌细胞能通过奇奇怪怪的途径、顺利地来到另外一个人的身体里,也会被本地免疫系统识别为异己而清除掉。
但是,在这个病例里,接受了器官移植的人需要持续服用免疫抑制剂来控制排异反应,也就削弱了他们的免疫系统,这使得来自捐献者的癌细胞有机会逃脱接受者的免疫系统,存活下来,以至于一发不可收拾。
这并不是第一例有捐献者的癌细胞通过器官移植转移到接受者体内而引起肿瘤了。早在1965年,就已经有了肿瘤通过器官移植转移给器官接受者的病例报道[2, 3],因此,医疗界在进行器官移植的时候,会避免使用来自出现肿瘤扩散的晚期癌症患者的器官。
而来自“无癌”状态捐献者的器官,在移植后给接受者带来肿瘤的病例,也偶有发生[4]。这些不幸的事件,让科学家们判断出即使在“无癌”状态的人体内,也可能会有休眠癌细胞(dormant cancer cells)的存在。
什么是 休眠癌细胞 呢?
关于恶性肿瘤的扩散与转移,一般认为,扩散的癌细胞在离开了温室一般的原始病灶以后,不但背井离乡颠沛流离,还会遭遇免疫系统的围追堵截,因此大部分扩散的癌细胞都“报销”在扩散的途中了,只有少数幸存细胞得以潜伏下来、或者卡在病人体内的某个旮旯里,长期处于静止的休眠状态(dormancy),既不会被病人察觉,也没法被普通检测方法检测到[5-7]。
举个例子呢,2018年六月的 Science 杂志上,就有一项针对休眠癌细胞的研究[8]。在未发现转移病灶的胰腺导管癌患者的肝组织样本里,研究人员检测到了少量的扩散的癌细胞(图2)。随后,他们在胰腺导管癌的小鼠模型里,也同样地在健康的肝部发现了少量的癌细胞。
这些形单影只的癌细胞,既不分裂也不乱跑,孤零零地呆在那里,处于休眠状态,就是休眠癌细胞了。
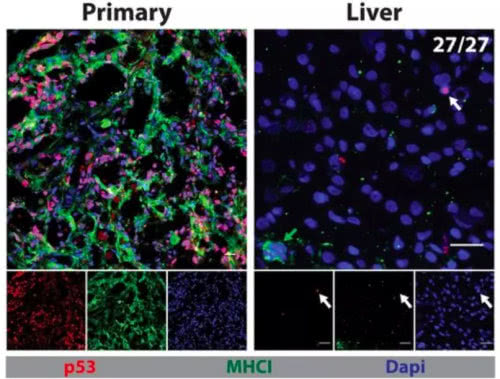
图2. 图左为胰腺导管癌原位病灶,图右为同一位患者的健康肝组织样本,红色为癌细胞(来源:文献[8])
在这项研究中,科学家们发现,在小鼠中扩散的胰腺导管癌细胞,大部分都会被免疫系统揪出来清理掉,只有很少数的癌细胞,会启动一种叫做未折叠蛋白反应(unfolded protein response,UPR)的模式,从而进入不活跃的休眠状态,同时也减少自己表面一些特征分子的表达,长得不再像坏细胞了,就能逃过免疫细胞的法网,在某个旮旯潜伏起来。等到有一天,科学家们出手抑制了小鼠癌细胞里这种促休眠的未折叠蛋白反应,并削弱小鼠免疫系统的时候,这些躲过了前一波免疫系统大清洗的休眠癌细胞就可能有机会苏醒过来,再度进入活跃的生长期(图3)。
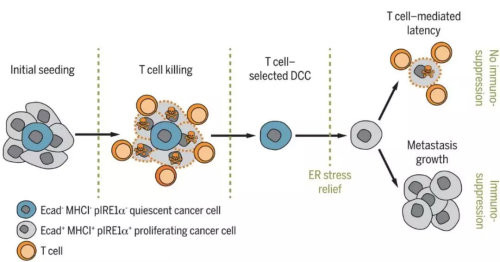
图3. 休眠癌细胞逃脱免疫系统的清剿(来源:文献[8])
幸运的是,并不是所有的休眠癌细胞都能复苏。只有极少数的休眠癌细胞,在经过漫长的时间后,机缘巧合之下才会复苏,就像随风飘散的种子找到了合适的土壤和气候那样,野火烧不尽,春风吹又生,逐渐长成能被感受到或检测到的转移病灶,从一个小概率事件发展出很大的麻烦。
休眠癌细胞能否复苏,除了癌细胞本身的个性以外,它周围的环境因素也起到了重要的作用。
比如说,2016年,Mikala Egeblad领导的研究团队在 Science Translational Medicine 上发表论文[9],描述了他们在乳腺癌的小鼠模型里通过活体显微成像技术观察到的一个有意思的现象:在一些转移到小鼠肺部的乳腺癌细胞周围,有一种叫做嗜中性粒细胞的免疫细胞在徘徊游荡,并且释放出一种叫做嗜中性粒细胞胞外陷阱(Neutrophil Extracellular Traps, NETs)的特殊结构(动图4来自[9],其中红色的是位于小鼠肺部的乳腺癌细胞,绿色的是嗜中性粒细胞,蓝色的则是嗜中性粒细胞胞外陷阱)。在转移性乳腺癌的病人样品中,也发现了同样的结构。
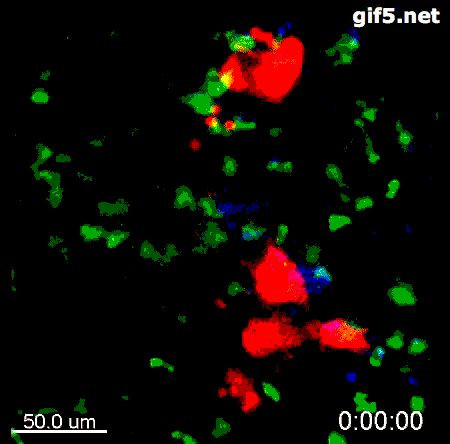
图4. 嗜中性粒细胞胞外陷阱NET,在电镜下看,就是图5里红箭头指出的那些网状结构:[10]
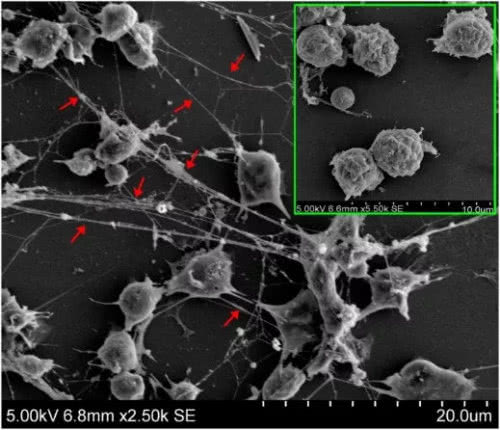
图5右上角绿框里的,是静息状态的嗜中性粒细胞,这些细胞在不工作的时候也是看起来很文静的,并不张牙舞爪。当它们被激活了以后,就会释放出网状的NET——NET是嗜中性粒细胞的武器和工具,有杀菌的功能,也会和细胞外基质进行一些反应,降解一些蛋白,从而为免疫细胞的活动腾挪出空间。
嗜中性粒细胞释放出NET,这是正常组织中炎症反应的重要组成部分。而Mikala Egeblad的团队则发现,在特定条件下,NET也可能会起到促进肿瘤转移的作用,当他们在小鼠里抑制NET,就能减少小鼠肺部的乳腺癌转移[9]。
这是为什么呢?2018年九月,Egeblad团队又在 Science 杂志上发文阐述了他们发现的原理[11]:原来,当肺部发生炎症反应的时候,炎症会激活嗜中性粒细胞,让它们释放出NET来开展免疫活动、进行清理工作,而这些NET在执行免疫功能的时候,会和胶原蛋白之类的细胞外基质进行反应——如果这些反应恰好发生在休眠癌细胞的附近,就会改变休眠癌细胞附近的基质,从而触发一系列的反应链来唤醒、复苏那些在休眠中的癌细胞,被激活的癌细胞就有了继而发展成转移肿瘤的可能。
简而言之,肺部一发炎,嗜中性粒细胞就得拿出扫帚NET清理炎症细胞,就有可能把附近休眠的癌细胞给折腾醒了 ,醒来的癌细胞就可能发展成肿瘤。
那,好端端的,肺部又为什么会发生炎症反应呢?有可能是因为细菌感染,也有可能是因为吸烟。最近有两项大型乳腺癌研究都发现了吸烟与乳腺癌的复发和死亡率有显著关联[12, 13],在Egeblad团队的乳腺癌小鼠模型中,曝露在香烟燃烧产生的烟雾中的小鼠,被香烟烟雾引发的肺部炎症,能唤醒扩散到肺部的休眠乳腺癌细胞,长出的乳腺癌转移病灶比不吸烟的小鼠要多得多[11](图6来自[11])。
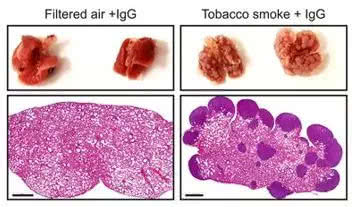
吸烟有害健康!
参考文献
1.Matser, Y. A. H. et al. Transmission of breast cancer by a single multiorgan donor to 4 transplant recipients. American journal of transplantation : official journal of the American Society of Transplantation and the American Society of Transplant Surgeons 18, 1810-1814, doi:10.1111/ajt.14766 (2018).
2.McIntosh, D. A. et al. HOMOTRANSPLANTATION OF A CADAVER NEOPLASM AND A RENAL HOMOGRAFT. Jama 192, 1171-1173 (1965).
3.Martin, D. C., Rubini, M. & Rosen, V. J. CADAVERIC RENAL HOMOTRANSPLANTATION WITH INADVERTENT TRANSPLANTATION OF CARCINOMA. Jama 192, 752-754 (1965).
4.Strauss, D. C. & Thomas, J. M. Transmission of donor melanoma by organ transplantation. The Lancet. Oncology 11, 790-796, doi:10.1016/s1470-2045(10)70024-3 (2010).
5.Kang, Y. & Pantel, K. Tumor cell dissemination: emerging biological insights from animal models and cancer patients. Cancer Cell 23, 573-581, doi:10.1016/j.ccr.2013.04.017 (2013).
6.Demicheli, R., Abbattista, A., Miceli, R., Valagussa, P. & Bonadonna, G. Time distribution of the recurrence risk for breast cancer patients undergoing mastectomy: further support about the concept of tumor dormancy. Breast Cancer Res Treat 41, 177-185 (1996).
7.Demicheli, R., Retsky, M. W., Hrushesky, W. J. & Baum, M. Tumor dormancy and surgery-driven interruption of dormancy in breast cancer: learning from failures. Nature clinical practice. Oncology 4, 699-710, doi:10.1038/ncponc0999 (2007).
8.Pommier, A. et al. Unresolved endoplasmic reticulum stress engenders immune-resistant, latent pancreatic cancer metastases. Science 360, doi:10.1126/science.aao4908 (2018).
9.Park, J. et al. Cancer cells induce metastasis-supporting neutrophil extracellular DNA traps. Science translational medicine 8, 361ra138, doi:10.1126/scitranslmed.aag1711 (2016).
10.Zhao, M. L., Chi, H. & Sun, L. Neutrophil Extracellular Traps of Cynoglossus semilaevis: Production Characteristics and Antibacterial Effect. Frontiers in immunology 8, 290, doi:10.3389/fimmu.2017.00290 (2017).
11.Albrengues, J. et al. Neutrophil extracellular traps produced during inflammation awaken dormant cancer cells in mice. Science 361, doi:10.1126/science.aao4227 (2018).
12.Pierce, J. P. et al. Lifetime cigarette smoking and breast cancer prognosis in the After Breast Cancer Pooling Project. J Natl Cancer Inst 106, djt359, doi:10.1093/jnci/djt359 (2014).
13.Wu, A. H. et al. The California Breast Cancer Survivorship Consortium (CBCSC): prognostic factors associated with racial/ethnic differences in breast cancer survival. Cancer causes & control : CCC 24, 1821-1836, doi:10.1007/s10552-013-0260-7 (2013).



